글_이대목동병원 신경과 김건하/가천대학교 길병원 신경과 박기형
1. 레카네맙이란?
레카네맙(상품명: Leqembi®)은 아밀로이드-베타 플라크 중 특히 프로토피브릴(protofibril) 형태에 선택적으로 결합하는 항아밀로이드 단클론항체로, 아밀로이드 병리로 인한 경도인지장애(mild cognitive impairment, MCI) 또는 경도 알츠하이머병 치매 환자를 위한 질병조절치료제(Disease Modifying Therapy, DMT)이다.
Clarity AD로 명명된 3상 임상시험에서는2 MCI 또는 경도 알츠하이머병 치매 환자 1,795명을 대상으로 18개월간 레카네맙 치료 효과를 평가했다. 그 결과 레카네맙 투여군(898명)은 위약군(897명) 대비 CDR-SB 점수 상승이 유의하게 적었으며(-0.45점 차이, P<0.001), 인지기능 저하 속도가 둔화되는 양상을 보였다. 아밀로이드 PET 영상 분석에서는 아밀로이드 플라크의 양이 위약군 대비 유의하게 감소하였고(-59.1 센틸로이드, P<0.001), 보조 평가 지표(ADAS-cog14, ADCOMS, ADCS-MCI-ADL)에서도 통계적으로 유의한 개선 효과가 확인되었다.
본 가이드라인은 대한치매학회의 권고안1을 바탕으로, 임상 현장에서 레카네맙을 안전하고 효과적으로 사용하기 위한 적절한 대상자 선정, 투약 방법, 이상반응 관리 등의 핵심 내용을 정리하였다.
2. 레카네맙은 어떤 환자에게 사용해야 하는가?
레카네맙은 아밀로이드 PET 또는 뇌척수액(CSF) 검사를 통해 아밀로이드 병리 양성이 확인된 경도인지장애(MCI) 또는 경도 알츠하이머병 치매 환자에게 사용이 권장된다. 이 중에서도 임상치매평가척도(Global Clinical Dementia Rating, CDR) 총점이 0.5~1점인 초기 단계 환자가 주요 대상이다(표 1). 대한치매학회 권고안에서는 레카네맙 3상 임상시험, 미국의 Alzheimer’s Disease and Related Disorders Therapeutics Work Group(ADRD-TWG)에서 제시한 권고안2 및 일본 후생노동성 권고안3에서 간이정신상태검사(MMSE) 22-30점으로 초기 환자를 정의하는대신, CDR 점수로 초기 환자를 정의하였다. 이는 한국의 고령 저학력자 중 MMSE 22점 미만이더라도 경도인지장애일 가능성이 있음에도 치료 대상에서 제외되는 문제를 방지하기 위한 것이다.
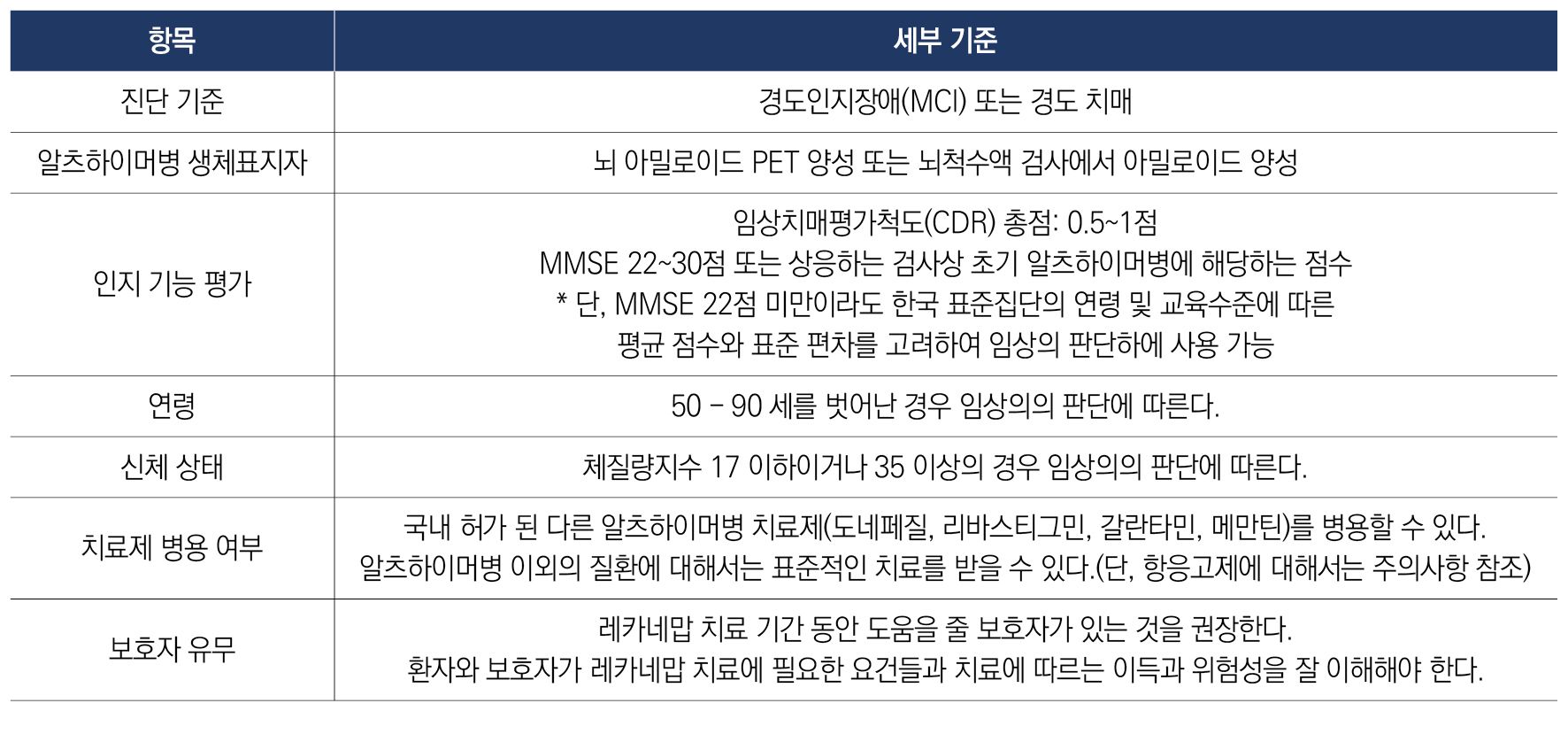
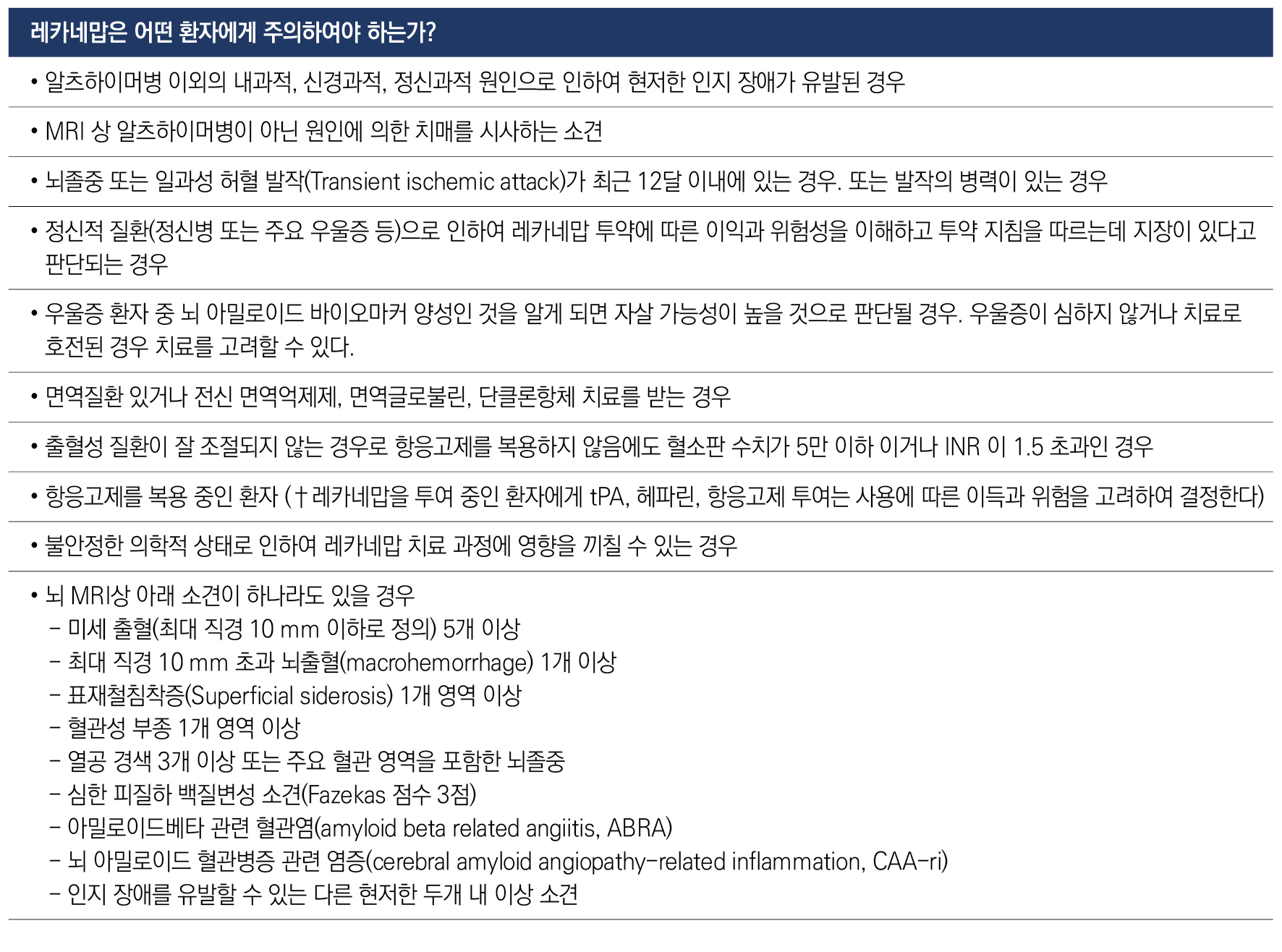
3. 레카네맙은 어떤 환자에게 주의하여야 하는가?
4. 레카네맙은 어떤 환자에게 금기하여야 하는가?
5. 레카네맙의 적절한 사용을 위해 필요한 검사
레카네맙의 치료 적합성을 평가하고, 부작용 위험을 최소화하기 위해 다음의 검사를 사전에 시행해야 한다.
1) 알츠하이머병 생체 표지자 검사
투약 전, 아밀로이드 PET 또는 뇌척수액(CSF) 검사를 통해 아밀로이드 병리 양성 여부를 확인해야 한다.
2) 최근 뇌 MRI 검사
투약 전 12개월 이내에 촬영한 뇌 MRI가 필요하며, ARIA (Amyloid-Related Imaging Abnormalities) 위험 평가를 위해 필수적으로 시행해야 한다. 최소 1.5T 이상 장비로 촬영하되, 3T 장비 사용이 권장된다. 영상 기법에는 FLAIR (Fluid-Attenuated Inversion Recovery), T2 GRE (Gradient Recalled Echo) 또는 SWI (Susceptibility Weighted Imaging)* 그리고 DWI (Diffusion-Weighted Imaging) 가 포함되어야 한다.
3) APOE 유전자형 검사
APOE4 보유자는 ARIA 발생 위험이 증가하므로, 치료 전 APOE 유전자 검사를 통해 개별 위험도를 평가해야 한다. 검사 결과를 바탕으로, 환자 및 보호자와 레카네맙 치료의 이점과 위험성에 대해 충분히 논의해야 한다.
6. 투약 방법 및 용량
7. 레카네맙 투약 중 발생 가능한 부작용의 모니터링 및 대처 방법
1) 주입 관련 이상반응의 모니터링 및 치료
레카네맙 투약 시 발열, 오한, 두통, 메스꺼움 등 주입 관련 이상반응이 발생할 수 있다. 임상시험에서는 투여군의 약 26.4%에서 이상반응이 보고되며, 대부분은 첫 2회 투약 내, 특히 첫 회 투약 시 발생한다. 대부분의 반응은 경증에서 중등도 수준이며, 24시간 이내에 호전되는 것으로 나타난다.
이상반응이 2등급 이상일 경우 투약을 일시 중단하고, 증상이 경미하면 항히스타민제와 아세트아미노펜, 심한 경우에는 스테로이드를 포함한 치료가 필요하다. 이후 투약 시에는 예방적 전처치(항히스타민제, 아세트아미노펜 ± 스테로이드)를 고려할 수 있다.
첫 투약 시에는 3시간 이상 병원 관찰이 권장되며, 2~3회차에는 2시간 관찰 후 이상 없을 경우 귀가가 가능하다. 주입관련이상반응을 모니터링하기 위해 레카네맙 첫 투약 시 최소 3시간 이상 병원에서 관찰하는 것이 권장된다. 2~3회차 투약 시에는 2시간 동안 관찰하고 이후 이상반응이 없다면 30분 정도 관찰 후 귀가 가능하다.
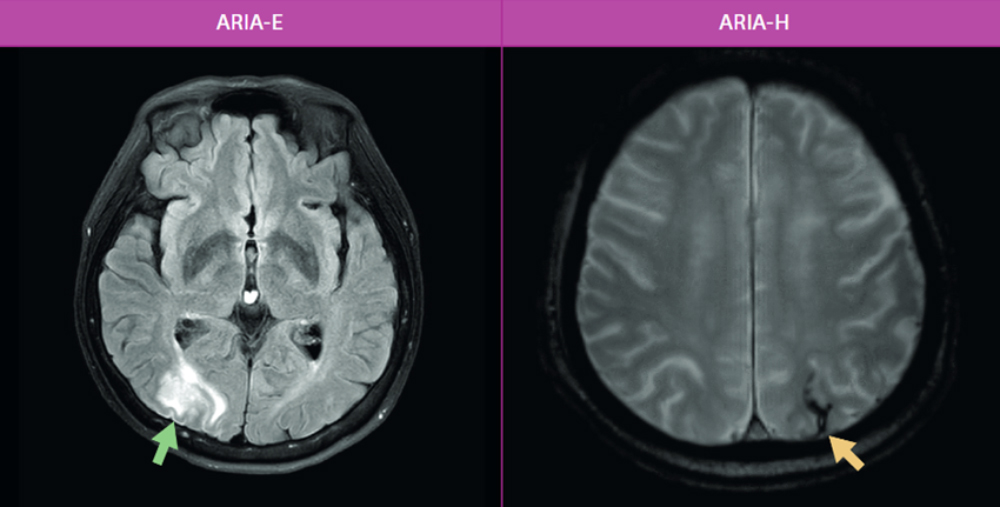
2) 아밀로이드 관련 영상 이상 (ARIA)
ARIA는 항아밀로이드 항체 치료 과정 중 나타날 수 있는 영상학적 이상 소견을 의미하며, 주로 뇌부종(ARIA-E) 또는 뇌출혈(ARIA-H) 형태로 나타난다.
- ARIA-E는 뇌 실질 또는 지주막하 공간에 삼출물이 축적되어 발생하며, 두통, 혼란, 시야 변화 등의 증상이 동반될 수 있다. 대부분의 경우 4개월 이내에 호전된다.
- ARIA-H는 미세출혈이나 드물게 혈종 형태로 나타나며, 대부분 무증상으로 MRI에서 발견된다.
Clarity AD 연구에서는 레카네맙 투여군의 21.5%에서 ARIA가 발생했으며, 대부분은 첫 7회 이내에 나타난다. 이 중 증상이 동반된 경우는 3%, 중증은 0.7% 수준으로 보고된다.
3) APOE 유전자형과 ARIA 위험도
ARIA의 발생 위험은 APOE4 유전자 보유 여부에 따라 달라진다. ε4 동형접합자는 ARIA-E가 32.6%, ARIA-H가 39.0%로, 다른 유전자형보다 현저히 높은 발생률을 보인다. 따라서 레카네맙 투여 전에는 APOE 유전자 검사를 통해 위험도를 평가하는 것이 권장된다.
4) ARIA 발생시 대처 방법
ARIA 발생 시에는 영상 소견의 중증도와 임상 증상의 유무에 따라 투약 지속 여부를 결정해야 한다.
- 무증상이고 영상학적으로 경도일 경우 투약을 지속한다.
- 영상에서의 중등도 이상 또는 증상 동반 시 투약을 일시 보류하거나 중단한다.
- ARIA-E는 이상이 사라질 때까지 보류하며, 2~4개월 후 추적 MRI를 통해 평가한다. 심각한 ARIA-E가 발생한 경우, 고용량 글루코코르티코이드 (예: 메틸프레드니솔론 1g IV, 5일간)로 초기 치료를 고려할 수 있으며, 경련 (뇌전증)이 발생한 경우, 필요시 적절한 모니터링과 치료를 시행한다.
- ARIA-H는 MRI에서 방사선학적 안정화가 나타나고, 증상이 있을 경우 증상이 소실될 때까지 보류하며 중증 ARIA-H가 발생한 경우에는 영구 중단 여부를 임상의가 판단한다.
8. 결론 및 요약
대한치매학회의 권고안은 지금까지 발표된 연구결과를 바탕으로 국내실정을 반영하여 제작되었다. 다만, 국내에서는 아직 레카네맙의 사용 경험이 충분하지 않고, 실제 임상에서의 효과 및 부작용 양상이 임상시험과 차이를 보일 수 있으므로, 체계적인 실사용(real-world) 데이터의 축적이 필요하다. 이에 따라 대한치매학회는 JOY-ALZ (Korean JOint RegistrY for ALZheimer’s Treatment and Diagnostics) 레지스트리를 구축하여, 레카네맙을 포함한 신약 및 진단기술의 임상 현장 적용 데이터를 수집하고, 이를 기반으로 향후 개정된 사용 권고안을 마련할 계획이다. 대한치매학회 권고안의 전문은 대한치매학회지(Dementia and Neurodegenerative Disorder) 2024년 10월호에 영문과 국문으로 개제되어 있으며, 대한치매학회 홈페이지에서 다운받을 수 있다.

1. Park KH, Kim GH, Kim C-H, Koh S-H, Moon SY, Park YH, et al. Lecanemab: Appropriate Use Recommendations by Korean Dementia Association. Dement Neurocogn Disord 2024;23:165-187.
2. Cummings J, Apostolova L, Rabinovici GD, Atri A, Aisen P, Greenberg S, et al. Lecanemab: Appropriate Use Recommendations. J Prev Alzheimers Dis 2023;10:362-377.
3. Ministry of Health LaW. Optimal Use Promotion Guidelines Lecanemab (genetical recombination): Japanese Ministry of Health, Labour and Welfare, 2023.
4. Reish NJ, Jamshidi P, Stamm B, Flanagan ME, Sugg E, Tang M, et al. Multiple Cerebral Hemorrhages in a Patient Receiving Lecanemab and Treated with t-PA for Stroke. N Engl J Med 2023;388:478-479.