대한신경과학회 회원을 위한 통증 CME 교육
(Neuromodulation therapy in chronic pain)
글_백설희(고려대안암대병원 신경과)
1. 신경조절요법
신경조절(neuromodulation)은 전기나 화학작용제와 같은 자극을 신체의 특정 부위에 전달하여 신경세포활동(neuronal activity)을 변화시키는 것이며, 작용기전은 신경성형(neuroplasticity)을 촉진하여 기능개선에 관여하는 것이다. 신경조절은 세포 수준에서는 개별 세포의 전기상태를 변화시키고, 신경호르몬 수준에서는 신경전달물질의 활성을 초래하며, 네트워크 수준에서는 신경회로(neural circuit)의 변화를 유발하여 최종적으로 기능변화를 유도한다. 신경조절은 자극하는 신경의 부위, 자극하는 방법 등에 따라 분류할 수 있으며, 신경조절을 위해 수술접근이 필요한 경우를 침습신경조절요법이라고 하며, 수술접근 없이 신경에 자극을 주는 경우를 비침습신경조절요법이라고 한다. 신경계 질환에서 활용되는 대표적인 신경조절요법으로는 파킨슨병, 본태떨림, 근긴장이상 등에 활용되는 뇌심부자극(deep brain stimulation)이 있으며, 난치뇌전증에서의 미주신경자극술, 그리고 인지기능장애나 기분장애 등에 이용되는 경두개자기자극(transcranial magnetic stimulation) 등이 있다. 이외에도 다양한 신경조절요법이 신경계 질환에서 활용되고 있으며, 향후 기술이 발전하면서 임상에서의 활용영역이 확대될 것으로 기대된다.
2. 만성통증에서 신경조절요법
만성통증치료에서 전기자극치료의 이론적 배경은 1967년 Melzack와 Wall이 제시한 관문조절이론(gate control theory)이다. 빠른 전달속도의 기계수용기(mechanoreceptive) Aβ 섬유에 대한 자극이 Aδ 및 C 섬유에 의해 전달되는 통각신호(nociceptive signal)를 억제하며, 이를 통해 진통효과를 보일 수 있다는 것이다. 통증에서 신경조절요법은 자극 위치에 따라 척수자극, 말초신경자극 및 대뇌자극으로 구별할 수 있으며, 수술 유무에 따라 침습 및 비침습신경조절요법으로 나뉜다. 아래 그림은 만성통증치료에서 활용되는 신경조절요법을 정리한 그림이다(Knotkova H, et al. Lancet 2021).
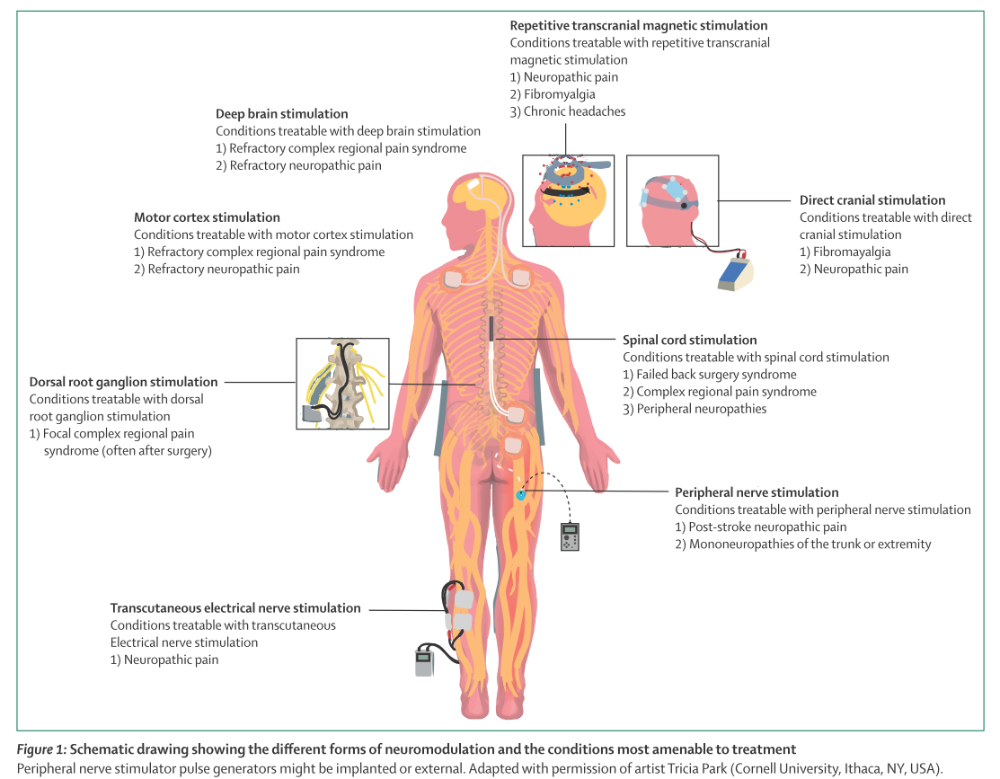
1) 침습신경조절요법
● 척수자극술(Spinal cord stimulation)
척수자극술은 만성통증을 조절하기 위해 척수 등쪽기둥의 경막외부위에 2개의 전극을 삽입하고, 이와 연결된 신호자극기를 피하에 이식한다. 척수자극술은 수술후만성등과다리통증(post-surgical chronic back and leg pain), 복합부위통증증후군(complex region pain syndrome, CRPS) 등에서 널리 활용되고 있다. 전통적인 척수자극술은 20-120 Hz의 자극빈도이고, 300 Hz 이하의 자극빈도에서는 자극 부위 아래로 이상감각이 유발될 수 있다. 통증의 호전은 통증영역의 이상감각과 연관이 있다. 새로운 척수자극술로는 고빈도척수자극술, Burst척수자극술, 폐회로(closed loop) 척수자극술 등이 있다. 고빈도척수자극술은 30 μs의 짧은 자극시간(duration), 10,000 Hz 고빈도와 1-5 mA의 저강도 자극을 주는 방법이며, 만성신경병통증에 대해 잠재적인 효과가 있을 것으로 미국 국립보건연구원의 가이드라인에서 제시하였다. Burst척수자극술은 500 Hz의 펄스내 빈도, 1 ms 자극과 1 ms 간극의 펄스 너비 보이는 5회 연속 파형의 펄스열(pulse train) 자극을 주는 방식이다. 폐회로척수자극술은 개방회로(open-loop)인 일반적인 척수자극술과 달리 유발된 복합활성전위의 실시간 기록, 신경섬유의 활성화 측정이 가능하다는 장점이 있다. 또한, 전극의 위치를 neural foramen에 위치하여 등뿌리신경절(dorsal root ganglion)을 자극하여 통증을 조절하는 등뿌리신경절척수자극술도 있다.
이전 연구에서 척수자극술은 failed back surgery syndrome (FBSS)에서 일반적인 약물치료나 재수술과 비교하여 더 나은 효과를 보이는 것으로 보고되었으며(low-to-moderate quality evidence), 최소 2년간 삶의 질의 호전을 보이는 것으로 나타났다(low quality evidence). CRPS에서는 일반적인 약물치료와 비교하여 통증의 감소 및 삶의 질이 개선되는 효과를 보였으며(moderate quality evidence), 말초신경병에도 일반적인 약물치료보다 나은 효과를 보인 경우들이 보고되었다(low-to-moderate evidence). 2016년 EAN 가이드라인에서는 당뇨신경병, 수술후만성등과다리통증, CRPS에서 일반적인 약물치료에 추가적으로 척수자극술을 시행하는 것과, 수술후만성등과다리통증에 있어서 재수술 대신 척수자극술을 시행하는 것이 권고되었다(weak recommendation).
● 뇌심부자극(Deep brain stimulation, DBS)(Spinal cord stimulation)
뇌심부자극은 뇌의 특정 부위에 전극을 삽입하고, 삽입된 전극을 통해 전기자극을 주는 것으로 1950년대에 뇌심부자극을 통한 통증의 감소에 대한 개념이 등장하였다. 만성통증에 대한 자극 부위는 주로 diencephalic periventricular gray matter, mesencephalic periaqueductal gray matter, sensory thalamus와 anterior cingulate cortex 부위이다. Ventral diencephalic periventricular gray matter나 mesencephalic periaqueductal gray matter를 자극하면 비아편성 진통효과를 유발하는 반면, dorsal diencephalic periventricular gray matter를 자극하면 내인성 아편성 진통효과를 보이는 것으로 생각된다. 통증치료를 위한 뇌심부자극은 현재 미국 FDA에서 승인되지 않았지만, 일부 국가에서 off-label로 시행되고 있다. 2016년 EAN 가이드라인에서는 신경병통증에 있어서 뇌심부자극에 대한 권고를 결정하지 못하였다(inconclusive).
2) 비침습신경조절요법
● 반복경두개자기자극 (Repetitive transcranial magnetic stimulation, rTMS)
반복경두개자기자극(repetitive transcranial magnetic stimulation, rTMS)은 전자기코일을 통해 자기장을 형성하고, 이를 통해 표면 축삭의 탈분극 및 피질의 신경네트워크 활성화를 위한 전류를 유발하여 신경세포흥분성(neuronal excitability)을 조절하는 신경조절요법이다. rTMS는 여러 변수에 따라 효과가 달라질 수 있는데, 코일의 종류 및 방향, 코일과 뇌 사이의 거리, 자기장 파형, 자극의 강도, 빈도 및 패턴 등이 영향을 미칠 수 있다. 자극코일은 5-20 Hz 사이의 자극을 주는 경우 고빈도 rTMS라고 하며 흥분(excitatory)효과가 있는 반면, 1 Hz 혹은 그 미만의 자극은 저빈도 rTMS이며 억제(inhibitory) 효과가 있는 것으로 알려져 있다. 통증치료에서 rTMS의 자극부위는 주로 primary motor cortex (M1)이며, 이외에 dorsolateral prefrontal cortex를 주로 자극한다. M1을 타깃으로 하는 고빈도 rTMS 연구에서 단일세션자극 시 진통효과가 6-8일 정도 지속되는 것으로 보이며, 효과를 늘리기 위해서는 최소 1주일 간 매일 반복자극이 필요하다. 또한 치료목적을 위해 유지요법도 필요하다. 일반적으로 매우 안전하며 주된 부작용으로 일시적인 두통이 있을 수 있다. 금기는 뇌전증, 뇌종양 및 심박조율기를 가진 경우 등이다.
2016 EAN 가이드라인에서 신경병통증 및 섬유근육통에 대해 M1부위를 자극하는 rTMS에 대해 약한 권고(weak recommendation)를 하였다. 하지만, CRPS에서 M1 타깃 rTMS나 신경병통증과 섬유근육통에서 dorsolateral prefrontal cortex부위의 rTMS에 대해서는 권고수준을 결정하지 못하였다(inconclusive). 2020년 International Neuromodulation Society (INS) & North American Neuromodulation Society(NANS) 전문가 패널에서는 만성통증에서 rTMS 치료에 대해서 CDC level IB recommendation으로 제시하였고, M1 뿐만 아니라 미만성 신경병통증이나 심한 우울증이 동반된 환자에서는 대체치료로 좌측 dorsolateral prefrontal cortex의 치료를 고려할 수 있다고 제시하였다. 2020 INA-NANS에서 제시한 만성신경병통증의 rTMS 치료 프로토콜로 다음과 같다.
- 심한 우울증이 없는 신경병통증: 5 - 10 induction session (24 - 72 시간 interval), 10 - 20 Hz, 2000 - 3000 pulses/session, 자극 강도: resting motor threshold의 80 - 90%, 자극위치: contralateral M1 (일측성 신경병통증의 경우) 또는 좌측 dorsolateral prefrontal cortex (미만성 신경병통증의 경우).
- 심한 우울증을 동반한 신경병통증: 최소 10회 induction session (24 - 72 시간 interval), 10 - 20 Hz, 2000 - 3000 pulses/session, 자극 강도: resting motor threshold의 80 - 90%, 자극위치: 좌측 dorsolateral prefrontal cortex (미만성 신경병통증), 이후 2주마다 혹은 1달마다 유지치료세션을 시행
● 경두개직류전기자극(Transcranial direct current stimulation, tDCS)
tDCS는 신경세포흥분성을 조절하기 위해 널리 사용되는 비침습적 장비이며, 0.5-3 mA의 약한 전류를 두피에 가하여 뇌신경의 탈분극 혹은 과분극을 유발한다. tDCS의 효과는 극성에 따른 차이가 있는데, 양극자극(anodal stimulation)은 신경기능을 흥분시키고, 반대로 음극자극 (cathodal stimulation)은 억제하는 효과가 있다. 생물학적 효과를 형성하기 위해서 최소 5분 이상의 자극시간이 필요하다. 긴 자극시간은 NMDA수용체를 조절하는 glutamatergic calcium-dependent neuroplasticity를 유발하며, GABA, 세로토닌, 도파민, 아세틸콜린을 포함하는 여러 신경전달물질과 상호작용을 하게 된다. 임상적으로 유의미한 효과를 얻기 위해서 여러 세션으로 반복 자극하는 것이 필요하다. 일반적으로 tDCS의 자극부위는 primary motor cortex (M1), 좌측 dorsolateral prefrontal cortex가 있으며, 편두통의 경우 primary visual cortex (V1)가 있다. 국소 혹은 편측 통증인 경우 대부분 통증의 반대측 M1을 자극하고, 통증이 광범위한 경우라면 우세대뇌반구(좌측)에 양극자극을 시행한다. M1 자극의 전극위치는 국제 10-20체계의 C3/C4에 해당된다. 많은 연구에서 35 cm2 전극 크기로 2 mA의 자극강도로 주며, 자극 시간은 주로 10-20분 이내로 하고 20세션까지 반복하는 것으로 보고되었다.
2016년 EAN 가이드라인에서는 신경병통증에서 M1 부위를 자극하는 tDCS에 대해 약한 권고(weak recommendation)를 제시하였지만, 척수손상과 섬유근통증후군에서 M1 부위를 자극하는 tDCS나 dorsolateral prefrontal cortex부위를 자극하는 tDCS에 대해서는 권고수준을 결정하지 못하였다(inconclusive).
다음은 2016년 EAN 가이드라인에서 제시한 만성통증에서 신경조절요법의 권고수준을 정리한 표이다(Cruccu G, et al. European Journal of Neurology 2016).

Take home message
1. 신경조절은 전기나 화학작용제와 같은 자극을 신체의 특정 부위에 전달하여 신경세포 활동을 변화시키는 것으로 다양한 신경계질환에 적용할 수 있다.
2. 만성통증의 치료로 척수자극술, 뇌심부자극, 반복경두개자기자극 혹은 경두개직류전기자극 등 다양한 신경조절요법을 시도해 볼 수 있다.
3. 만성통증에서 신경조절요법은 약한 권고 수준 혹은 결론을 내리지 못한 경우가 대부분이지만, 향후 기술의 발전과 함께 지속적인 연구가 필요하다.

1. Knotkova H, Hamani C, Sivanesan E, et al. Neuromodulation for chronic pain. Lancet 2021; 397: 2111-24.
2. Cruccu, G., Garcia-Larrea L, Hansson P, et al. EAN guidelines on central neurostimulation therapy in chronic pain conditions. Eur J Neurol 2016; 23: 1489-99.
3. Lefaucheur JP, Aleman A, Baeken C, et al. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS): An update (2014-2018). Clin Neurophysiol 2020; 131: 474-528.
4. Lefaucheur JP, Antal A, Ayache SS, et al. Evidence-based guidelines on the therapeutic use of transcranial direct current stimulation (tDCS). Clin Neurophysiol 2017; 128: 56-92.
5. Leung A, Shirvalkar P, Chen P, et al. Transcranial magnetic stimulation for pain, headache, and comorbid depression: INS-NANS expert consensus panel review and recommendation. Neuromodulation 2020; 23: 267-90.
복합부위통증증후군
글_손성연(세란병원 신경과)
증례
61세 여자가 내원 3개월 전부터 지속되는 우측 아래팔과 손의 심한 통증을 호소하였다. 3개월 전 공사장에서 힘든 업무(페인트칠)를 종일토록 한 후 우측 아래팔의 바깥쪽과 손목 요골쪽 통증이 심한 부종과 함께 시작되었고, 당시 통증의 세기는 NRS (numerical rating scale, NRS) 10점으로 극심하였다. 인근 상급종합병원과 관절전문병원에서 검사 및 치료하였지만 NRS 7-8점의 통증이 지속되었다.
내원 2개월 전 상급종합병원 진찰에서 우측 상지의 전반적인 관절운동범위 감소와 더불어 근력은 우측 팔꿈치굽힘 MRC (medical research council) G3, 손목굽힘 G3+, 손가락벌림 G3으로 저하되었다. 신경전도검사는 정상이었고, 침근전도검사는 짧은엄지벌림근(abductor pollicis brevis, APB)에서 경미한 탈신경전위 소견 외에 모두 정상이었다. 초음파검사에서 우측 아래팔의 굽힘근(flexors), 엄지두덩(thenar), 새끼두덩(hypothenar)과 등쪽뼈사이(dorsal interosseous muscles) 근육의 지방변성이 관찰되었다고 하였다. 본원에서 시행한 진찰 결과, 팔꿈치 굽힘 MRC G4+, 손목굽힘 G40, 손가락벌림 G40 → G4+으로 호전된 상태였고, 통증양상은 저림, 칼로 베이는 듯한 느낌과 닿았을 때 따끔거리는 이질통(allodynia)을 호소하였다. 다시 시행한 신경전도검사는 정상, 침근전도검사에서 우측 APB의 경미한 탈신경전위와 동원(recruitment) 감소 소견이 보였으나 요측손목굽힘근(flexor carpi radialis)과 척측손목굽힘근(flexor carpi ulnaris, FCU)의 경우 경미한 탈신경전위와 동반된 작은 진폭 및 다상성의 운동단위와 함께 정상 동원양상을 보여 근육병성 변화(myopathic change)를 보였다.
신경초음파검사에서 주요 말초신경의 이상 소견은 없었지만, 우측 얕은손가락굽힘근(flexor digitorum sublimis, FDS), 깊은손가락굽힘근(flexor digitorum profundus, FDP) 및 FCU의 echogenicity가 다소 증가되었고 volar side의 superficial & deep compartment (FDS, FDP)의 근위축 소견이 관찰되었다(Fig. 1). 적외선체열검사(digital infrared thermal imaging, DITI)에서 반대편에 비해 우측 손의 온도가 증가되었다(Fig. 2). 환자의 병력과 진찰 및 검사 소견을 토대로 복합부위통증증후군(complex regional pain syndrome, CRPS) 1형으로 진단하였다. 복용하고 있던 진통소염제를 중단하면서 대신 신경병통증에 준하여 nortriptyline, pregabalin, lidocaine patch 등의 처방을 시작하여 서서히 증량하였고, 1개월 뒤 환자의 통증은 NRS 2-3점으로 호전되었다.
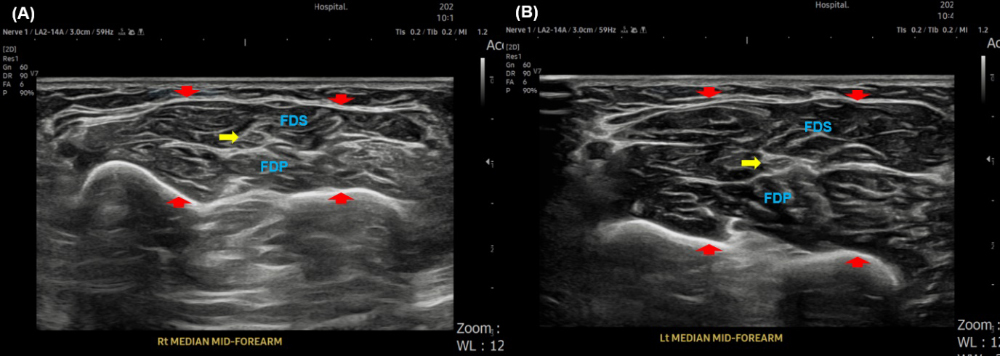
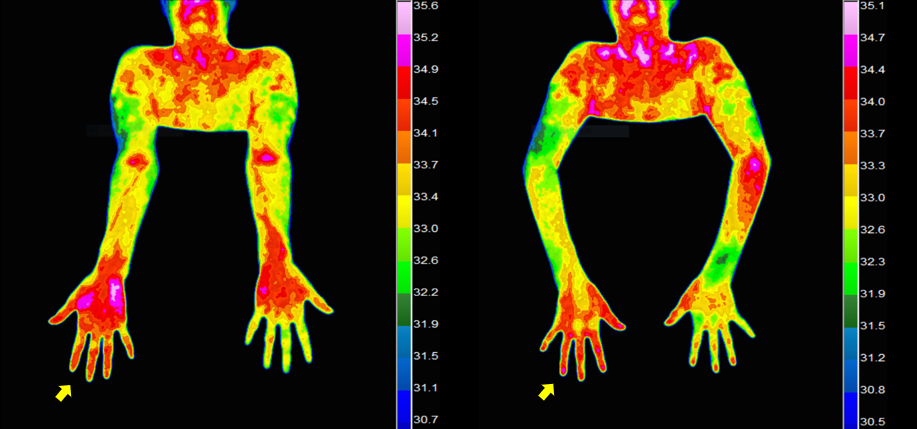
고찰
CRPS는 명확한 신경손상의 증거가 있는 경우 2형으로, 그렇지 않은 경우 1형으로 분류한다. 아직 병인기전은 분명치 않지만 한 가설에 따르면, 지속적인 심부조직손상(deep tissue injury)으로 인한 compartment-like syndrome, 뒤이어 발생하는 허혈-재관류 손상과 염증반응이 1형 CRPS의 핵심기전으로 제시된 바 있다.1 본 증례 역시 발병 당시 심한 부종이 있었으므로 이러한 가설은 설득력이 있는 것으로 생각된다.
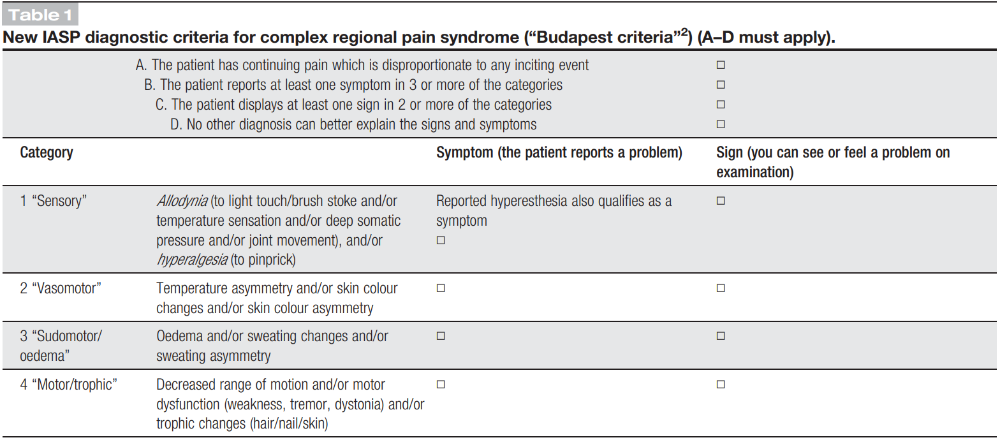
이 환자는 특징적인 증상 뿐만 아니라 DITI에서 확인된 온도 차이 및 근전도에서 확인되는 근육손상 소견, 그리고 초음파에서 동반된 근위축 등의 징후도 확인되어, CRPS 진단을 위한 Budapest criteria를 만족하였다(Table 1).2 환자는 발병 후 3개월이 지난 시점에 본원에 내원한 환자로, 어느 정도의 염증반응이 남아있는 warm CRPS 아형으로 판단되었다.3 한 다기관 연구에 따르면, warm CRPS는 cold CRPS에 비해 상대적으로 이환기간이 짧고, 3개월 뒤 추적하면 21.8%의 환자에서 CRPS가 호전되어 Budapest criteria를 만족하지 못하였다고 하였다.3 CRPS의 급성기 치료로 bisphosphonate와 단기간 glucocorticoid의 사용이 유의한 효과가 있는 것으로 보고되었다.4 그러나 급성기 이후에는 항우울제, 항경련제, Na 또는 Ca통로차단제, NMDA대항제, 항산화제 등 다양한 약제를 시도하지만 강력한 근거는 부족한 실정이다.5 또한 중재치료로 교감신경차단술, 체성신경차단술을 먼저 시도해보는 것이 일반적이지만, 통증이 적절히 경감되지 않으면 척수신경자극기나 척수강 내 이식형약물주입기도 적극적으로 고려해 볼 수 있다.4
Table 1. CRPS의 진단기준: “Budapest criteria” 2
Take home message
1. CRPS는 세심한 병력 청취와 신경학적 진찰을 바탕으로 전기진단검사와 초음파검사, 적외선체열검사 등의 결과를 참고하여 객관적 징후를 확인하면 용이하게 진단할 수 있다.
2. CRPS는 sensory, vasomotor, sudomotor/edema, motor/trophic changes의 4가지 범주에서 증상과 징후를 종합하여 진단한다.
3. CRPS 통증은 진통소염제에 잘 반응하지 않는 것이 특징이며 신경병통증에 대한 약제에 효과를 보이기도 한다.

1. Coderre TJ, Bennett GJ. A hypothesis for the cause of complex regional pain syndrome-type I (reflex sympathetic dystrophy): pain due to deep-tissue microvascular pathology. Pain Med 2010;11(8):1224-1238.
2. Goebel A, Birklein F, Brunner F, et al. The Valencia consensus-based adaptation of the IASP complex regional pain syndrome diagnostic criteria. Pain 2021;162(9):2346-2348
3. Bruehl S, Maihofner C, Stanton-Hicks M, et al. Complex regional pain syndrome: evidence for warm and cold subtypes in a large prospective clinical sample. Pain 2016;157(8):1674-1681.
4. Shin JW. Diagnosis and Treatment of Complex Regional Pain Syndrome. Hanyang Medical Reviews 2011;31:76-84.
5. Ferraro MC, Cashin AG, Wand BM, et al. Interventions for treating pain and disability in adults with complex regional pain syndrome- an overview of systematic reviews. Cochrane Database Syst Rev 2023;6(6):CD009416.
교육위원회Ⅰ: CASE CONFERENCE
글_오은혜(양산부산대병원 신경과)
CASE 1: 통증을 동반한 양안 복시를 보이는 27세 여자
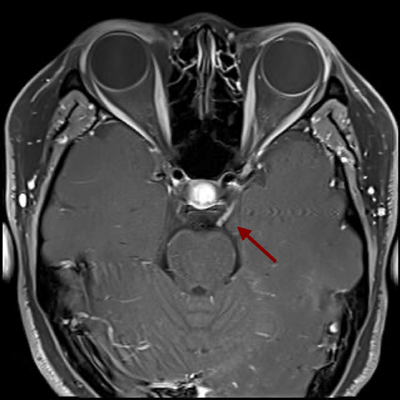
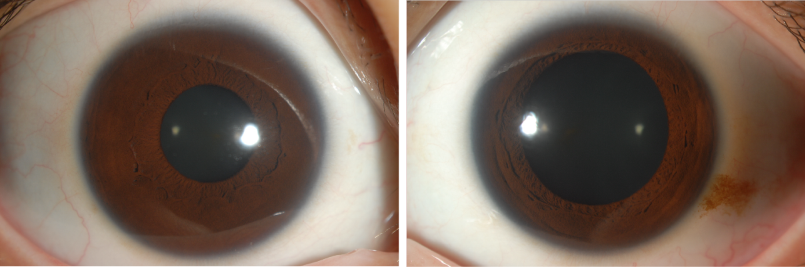
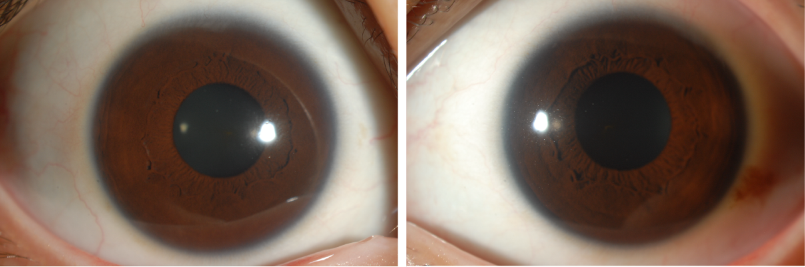
27세 여자가 약 1주일전부터 시작된 좌안의 통증, 빛 번짐, 눈꺼풀 처짐, 양안 복시로 내원하였다. 과거 16세, 23세때 매독치료를 한 병력이 있었으나, 추적 검사는 하지 않았다. 좌측 동공이 7mm로 우측 동공 4mm에 비해 커져 있었으며, 동공 빛반사반응은 우측에서는 정상이었으나 좌측은 나타나지 않았다. 0.125% pilocarpine test 에는 반응이 없었고 0.1% pilocarpine test 시 좌측 동공이 5mm로 줄어들었다. 좌안에 부분안검하수가 있었고 아래, 내측 주시시 좌안 운동에 제한이 있었다. HESS 검사에서 좌안의 하직, 내직근 마비가 있었다. 환자는 통증 안근마비 (부분 3번신경 마비, 동공 침범)를 확인할 수 있었고, 그 원인에 대한 평가를 위해 Blood study, MRI, 혈관평가, CSF study를 시행하였다. MRA 는 이상소견 없었으나, MRI 에서 해면정맥동에서 상안와열까지 눈돌림신경(oculomotor nerve)의 주행을 따라 조영증강 소견을 보였다. 일반혈액검사에서 특이소견은 없었지만 RPR 정성검사에서 양성이었으며, RPR 역가 1:16, TPLA 양성, FTA-ABS IgM 음성, IgG 양성 소견을 보였다. RPR 정성검사 양성 및 RPR 역가 1:16으로 신경매독 감별이 필요해 CSF study 를 시행하였으며 CSF study 상 cell 60, protein 78 로 모두 증가 되어있었고 CSF RPR 역가 1:4 였다. 환자는 신경매독 진단하에 페니실린 정주 치료를 시작하였다.

외안근마비와 눈 주위의 지속적이거나 파는 듯한 통증을 특징으로 하는 임상증후군을 통칭하여 통증안근마비(painful ophthamoplegia)라고 한다. 통증안근마비는 상안와열과 해면정맥동등을 침범하는 종양, 감염, 염증 또는 혈관질환으로 인해 발생할 수 있다. 특히 비특이적 육아종성 염증을 특징으로 하는 Tolosa-Hunt증후군이 가장 대표적인 질환이다. 해면정맥동이나 상안와열을 침범하지 않는 경우에도 다양한 안구질환, 당뇨환자에서 종종 보이는 당뇨병안근마비, 안근마비 편두통, 거대세포동맥염 에서도 통증안근마비가 나타날 수 있어 그 원인을 감별하는 것이 중요하다. 원인 감별을 위해 기본 혈액검사와 그 외 적혈구 침강속도, 안지오텐신전환효소, 항호중구세포질항체, 항핵항체, 이중나선DNA항체, 당화혈색소검사가 필요하며 뇌척수액검사도 함께 시행한다. 뇌, 뇌혈관영상도 시행하며 보통 MRI 검사를 시행한다. 영상검사 결과나 치료 반응에 따라서는 진단을 위한 생검이 필요한 경우도 있다.
통증안근마비 환자에 대해 체계적인 접근이 이루어지지 않을 경우 심각한 장애와 사망에 이를 수 있으므로 이에 대한 인석이 필요하다.


























