
국내 소개된 최신 항뇌전증약물
글_ 주은연(성균관의대 삼성서울병원 신경과)
Eun Yeon Joo, MD, PhD
Department of Neurology, Sleep and Epilepsy section, Neuroscience Center,
Samsung Medical Center, Sungkyunkwan University School of Medicine,
81 Irwon-ro, Gangnam-gu, Seoul 06351, South Korea
Tel: +82-2-3410-3597, Fax: +82-2-3410-0052
E-mail: ejoo@skku.edu, eunyeon1220.joo@samsung.com.
서 론
본 론
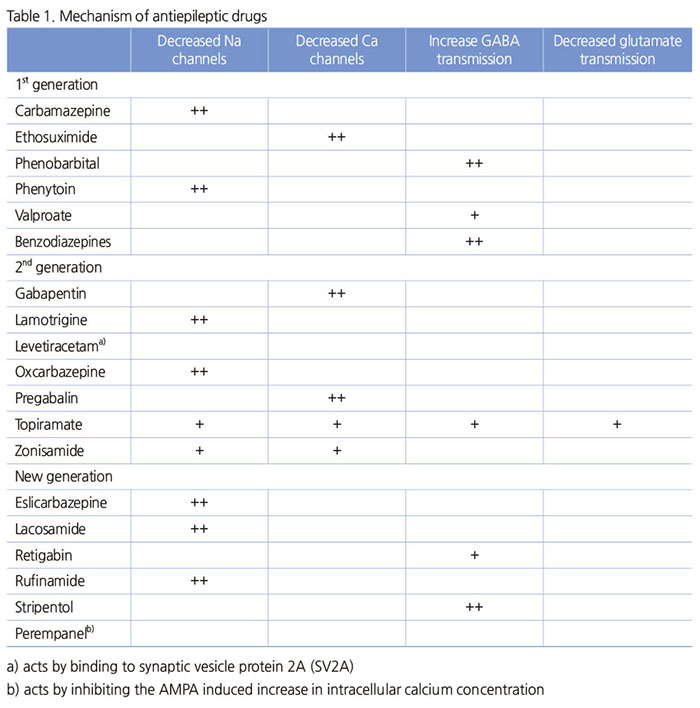
Lacosamide
국내에서 부분뇌전증의 부가요법으로 공인되었다. Sodium channel의 slow activation을 향상시키고, CRMP-2 (collapsing-response mediator protein 2)와의 결합을 통해 발작억제 효과를 나타낸다. 구강 복용 후 4시간 이내 최고 혈중 농도에 이르고, 배설 반감기는 13시간이다. 선적인 약물동력학을 보인다. CYP 효소들을 유도하거나, 억제하지 않고, carbamazepine, valproate에 의해 영향을 받지 않는다. 하루에 50 mg씩 두 번으로 시작하고 1주일에 100mg/day로 증량할 수 있고 효과 및 내성에 따라 200 혹은 400mg/day이 유지 용량으로 사용된다. 임상시험 연구결과에 근거하여 부가 요법으로 400mg/day까지 허가되었다. 위약에서 18.4%, 200mg/day에서 33.3%, 400mg/day에서 36.8%, 600mg/day에서 39.4%이었고, 50% 이상 발작 감소 환자 비율은 위약에서 22.6%, 200mg/day에서 34.1%, 400mg/day에서 39.7%, 600mg/day에서 39.6%이었다. 200과 400mg/day는 위약에 비해 모두 의미 있는 차이를 보였으나 400과 600mg/day에서 비슷한 효과를 보였다. 가장 흔한 부작용은 어지러움, 두통, 구역, 복시이며, 두통을 제외하고는 용량과 관련되었다.
Eslicarbazepine acetate
유럽에서는 부분뇌전증에서 부가 요법으로 공인되었으나, 국내에는 아직 들어오지 않았다. 정확한 작용 기전은 알려지지 않았지만 불활성 sodium channel의 site 2에 결합하여 급속도로 발포하는 신경세포를 선택적으로 표적하여 발작 억제를 한다고 추정한다. Eslicarbazepine acetate는 carbamazepine-10,11-epoxide로 대 사되지 않고 자가유도 대사가 없다. 배설 반감기는 13-20 시간으로 4-5일 내에 안정상태 농도에 이르게 되고 40% 이하로 단백질과 결합된다. Eslicarbazepine는 glucuronidation에 의해 비활성화되거나 변화하지 않은 채로 주로 신장으로 배설된다. 첫 권장 용량은 하루에 400 mg 한번 투여이며, 1-2주 하루 800 mg 한 번 투여하게 되고 효과 및 내성을 고려해 최대 1,200 mg/day까지 증량할 수 있다. 1-3개의 병용 약물을 복용하고 있는 부분뇌전증 환자 대상의 임상연구에서, 중간값의 발작 감소율은 위약에서 0.8-17%, eslicarbazepine acetate 1,200 mg/day에서 33-45%이었고, 50% 이상 발작 감소 환자 비율은 위약 13-20%, 1,200mg/day에서 37-43%이었다. 가장 흔한 이상 반응은 어지러움과 졸림이다.
Retigabine
2011년 미국(ezogabine)과 유럽에서 부분 뇌전증 환자의 부가 약물로 인가 받았다. 아직 국내에 들어오지 않았다. M-type potassium current를 조장시켜 신경의 voltage-gated potassium channels의 개통함으로써 발작을 억제한다. 또한 Retigabine은 GABA의 뇌 농도를 증가시키고 GABAA 수용체들에 긍정적으로 조절작용을 해 GABA-induced currents를 증진시킨다. 60-90분 내에 최고 혈중 농도에 이르며, 상대적으로 짧은 반감기로 인해 하루에 3번 분복한다. 위약과 600mg/day, 900 mg/day 비교 연구에서, 중간값 발작 감소율은 위약에서 15.9%, 600 mg/day에서 27.9%, 900 mg/day에서 39.9%이었고, 50% 이상 발작 감소 환자 비율은 위약에서 18.9%, 600 mg/day에서 38.6%, 900 mg/day에서 47.0%이었다. 가장 흔한 이상 반응들은 졸림, 혼동, 어지러움, 진전, 기억상실, 사고 이상, 현훈, 언어 장애, 무기력이다.
Rufinamide
Lennox-Gastaut 증후군의 부가요법으로 사용되는 희귀의약품으로 공인되었다. 국내에서도 희귀약품 센터를통해 약물을 구할 수 있다. 작용기전은 확실치 않으나, Voltage-dependent sodium channels의 불활성 상태를 연장시키며 신경 sodium 의존성 활동 전위의 지속적인 반복적 발포를 제한시킴으로써 발작억제를 하는 것으로 알려져 있다. 구강 투여로 85% 흡수되고 최고 혈중 농도는 5-6시간 내에 도달한다. 배설 반감기는 8-12시간이며, 대부분 간에서 대사한다. 하루에 200 mg씩 두 번 투여해서 2일 이상의 간격으로 하루에 400 mg씩 효과와 이상 반응을 고려해 최대 3,200mg/day까지 증량한다. Lennox-Gastaut 증후군 138명을 대상으로 12주 이중 맹검 위약통제 부가요법으로 시행한 결과, 전체 발작 감소율은 위약보다 의미 있게 높았고 (32.7% vs. 11.7%), 발작의 빈도가 50% 이상 감소한 환자의 비율은 rufinamide에서 31.1%, 위약에서 10.9%이었다. 긴장성-무긴장성 발작이 의미 있게 감소하였는데 (42.5% vs. -1.4%), 발작의 빈도가 50% 이상 감소한 환자의 비율은 rufinamide에서 42.5%, 위약에서 16.7%이었다. 소발작의 빈도도 의미 있게 감소하였다. 가장 흔한 이상 반응은 졸림, 구역, 구토, 식욕부진, 어지러움, 복시, 운동실조이다.
Stiripentol
GABAA 수용체 긍정적인 allosteric 조절 역할을 하는 기전을 가지며, severe myoclonic myoclonic epilepsy in infancy (Dravet’s syndrome) 환자에서 난치성 전신 긴장-간대성발작에 효과가 있다고 한다. 유럽에서 이 질환에 clobazam 및 valproic acid 치료의 부가 약물로 인가 받았다. 아직 국내에 도입되지 않았다. 한 임상연구에서, 전통적인 항뇌전증약물의 15%의 환자에서만 50% 이상 발작 감소를 보인 반면 stripentol로 61%의 환자에서 50% 이상 발작 감소를 보였다.
Perempanel
새로운 항전간제와도 매우 다른 기전을 갖는 약물로, 선택적 비경합적으로 AMPA 수용체를 길항하고, 시냅스 후부 AMPA 수용체의 글루탐산 활성에 선택적으로 작용해 신경세포의 이상흥분현상을 억제, 뇌전증과 관련된 뉴런의 과도한 자극을 감소시켜서 발작을 억제한다. 2016년 국내에서 출시되어, 12세 이상의 이차성 전신발작을 동반하거나 동반하지 않는 부분발작 치료 부가요법에 사용할 수 있다. 구강 섭취 후 15분-2시간 이내 혈중농도가 상승하고, 반감기가 70시간이어서, 하루에 1회 투여한다. 첫 2 mg부터 점차 증량하여 12mg 까지 투여 가능하다. Perempanel은 CYP 유도 혹은 non-CYP 유도 항전간제인 carbamazepine, topiramate, oxcarbazepine, levetiracetam, lamotrigine, valproate의 약물농도에 영향을 미치지 않는다. 다국적, 다기간 임상연구에서, 712명의 국소발작 환자에서 위약과 2, 4, 8mg/day perempanel을 비교한 결과, 약물투여 군에서 유의한 발작의 감소를 보였다. 가장 흔한 부작용은 어지럼증, 졸림, 두통, 피로감, 설사, 비염, 인후염과 발작이었으나, 대부분 경미했다.
결 론
다양한 기전과 보다 유리한 약물동력을 갖는 신약들의 등장은 난치성 뇌전증 환자들에게 보다 넓은 치료 기회를 제공한다. 신약의 가격이 비싸고, 약물 유효성이 구 세대 약물과 비슷하거나 다소 낮다고 평가되지만, 타 약물과의 상호 작용이 없거나 미미하고 부작용이 적어서 병용투여가 용이한 장점도 있다. 더 많은 뇌전증 약물이 개발되어 수술 혹은 시술이 어려운 난치성 뇌전증 환자들의 치료와 삶의 질 개선에 도움이 되길 바라며, 아직 국내에 들어오지 못한 새로운 약물의 조속한 도입을 촉구한다.


심방세동(atrial fibrillation, AF)의 유병률은 연령 증가에 따라 급속하게 증가하는 양상을 보이므로, 인구고령화가 급격하게 진행하고 있는 우리나라의 경우 향후 뇌졸중의 중요한 원인이 될 것이다. 최근 우리나라 국민건강보험자료를 분석한 연구에 의하면 2008년에서 2015년 사이 연간 발생률이 1.12배, 유병률은 1.68배 증가하였다. 그 결과 국민건강보험자료로 파악된 2015년 심방세동 환자 수는 276,246명이었다 (Int J Cardiol 2017;236:226-231). 심방세동 유병률 증가와 우리나라 허혈뇌졸중 환자에서 심인성 뇌졸중 비율이 점차 증가하고 있는데, 국내 대규모 레지스트리 연구를 종합하면, 전체 허혈뇌졸중 환자에서 심인성뇌졸중 비율이 2002년에는 14.7%였으나, 최근에는 21%를 넘었으며 전체 허혈뇌졸중 환자의 약 19%가 심방세동을 가지고 있었다 (Circ Cardiovasc Qual Outcomes 2012;5:327-334; J Stroke 2015;17:38-53). 따라서 뇌졸중 이차예방을 담당하고 있는 신경과 의사들은 항응고제 치료에 대해 잘 알고 있어야 한다.
심방세동에서 뇌졸중 예방을 위한 항응고제는 오랫동안 와파린만 사용할 수 있었으나, 약물과 음식과의 상호작용, 정기적인 피검사, 불안정한 약물 효과, 뇌출혈을 비롯한 주요출혈부작용에 대한 두려움, 그리고 특히 이런 문제점들은 우리나라를 비롯한 아시아인에서 더 두드려져 우리나라의 많은 환자와 의사들이 과도하게 항응고제 사용을 기피하고 있었다. 그러나 와파린을 대체할 수 있는 새로운 경구용 항응고제 (NOAC, new oral anticoagulant or non-vitamin K antagonist oral anticoagulant)가 개발되어 심방세동 환자에서 뇌졸중/전신색전증 예방효과에 대한 대규모 임상시험 (RE-LY, ARISTOTLE, ROCKET AF, ENGAGE AF-TIMI 48)이 성공한 이후 전세계적으로 NOAC의 사용이 늘어나고 있다. 본 글에서는 여러 임상시험 결과를 소개하는 것 보다는 진료실에서 NOAC의 실제적 사용에 있어 고려할 점에 대해 소개하고자 한다.
와파린과 비교하여 NOAC의 장점은 1) 투여 후 약 2시간이면 최대 효과가 나타나고, 중단 후 약물종류와 신기능에 따라 12-24시간만에 효과가 사라지며, 2) 약물과 식이와의 상호작용이 적고, 3) 신기능 (약물에 따라서는 나이 및 체중도 고려)에 따라 일정한 용량을 사용하므로 약물용량 조절에 따른 오류를 줄일 수 있고, 4) 자주 피검사를 시행하지 않아도 된다. 반면에 단점으로는 1) 신기능 배설률이 높으므로 신기능이 매우 낮으면 사용할 수 없고, 2) 와파린에 비해 비싸다는 점이다. 이전에는 antidote 가 없는 것이 문제였으나 개발이 완료되어 우리나라에서는 dabigatran의 antidote인 idarucizumab을 사용할 수 있으며, factor Xa inhibitor 의 antidote 도 머지않아 사용할 수 있을 것이다.
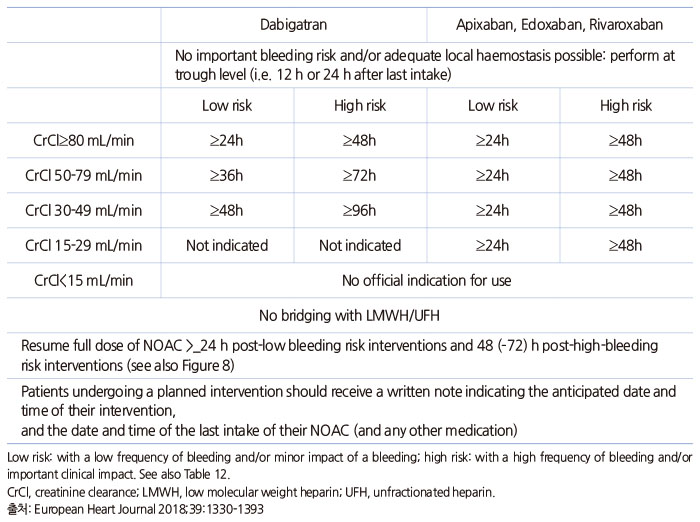
수술이나 관혈적 시술 전후 항응고제 일시 중단은 진료현장에서 가장 흔하게 접하는 문제이다. 와파린에 비해 NOAC의 중단 요령은 훨씬 간단할 뿐 아니라 중단기간을 줄여 뇌졸중/전신색전증 위험을 더 낮출 수 있다. 항응고제 중단 방법에 대해서는 European Heart Rhythm Association 2018 진료지침에서 제시한 아래 표를 참고하면 많은 도움이 된다.
Timing of last non-vitamin K antagonist oral anticoagulant intake before start of an elective intervention
와파린에서 NOAC으로 변경하고자 하는 경우 INR<2인 경우 바로 NOAC을 시작하면 된다. 그러나 INR>2인 경우에는 와파린 중단 후 3일째 INR을 평가하여 INRㄴ<2가 되면 NOAC을 바로 시작하고, INR 2-2.5인 경우는 바로 또는 다음날부터 시작하며, INR 2.5-3 사이라면 1-3일 후 다시 INR을 평가하여 결정하면 된다.
환자가 NOAC 복용을 잊은 경우 정상 복용간격의 50%를 기준으로 약물복용을 결정한다. 예를 들어 매일 아침 8시에 NOAC을 복용하는 환자라면 dabigatran/apixaban과 같이, 12시간마다 복용하는 경우에는 6시간이 지나지 않았으면 (오후 2시 이전) missing dose를 복용하고 저녁 8시에 원래 일정대로 복용하게 한다. 24시간마다 복용하는 rivaroxaban/edoxaban의 경우 12시간이 경과하지 않았다면 (오후 8시 이전) missing dose를 복용하고 다음 복용을 다음날 아침 8시에 하도록 한다. 만약에 그 시간이 지났다면 missing dose는 건너 띄우고 그 다음 복용하는 시간에 복용을 하도록 권고하고 있다. 만약에 환자가 착각하여 2배 용량을 복용하였다면 12시간마다 복용하는 NOAC의 경우 다음 복용을 건너 띄우게 하면 되고, 하루 24시간마다 복용하는 NOAC의 경우에는 다음 날에 약물 복용을 건너 띄우지 말고 표준 용량으로 복용하게 하는 것을 권고하고 있다.
NOAC 의 경우 신장을 통한 대사율이 dabigatran 80%, edoxaban 50%, rivaroxaban 35%, 그리고 apixaban 27% 이며, 신기능이 떨어지는 경우에는 용량을 감소시키거나 중단해야 한다. 따라서 정기적인 Creatinine clearance(CrCl)를 평가해야 하는데, 신기능 검사는 특별한 사건이 발생하지 않는 경우 1년에 100/CrCl 빈도로 하면 된다. 예를 들면 CrCl >90 ml/min이면 1회, 60 ml/min이면 2회, 33 ml/min이면 3회 정도 시행을 고려할 수 있다.
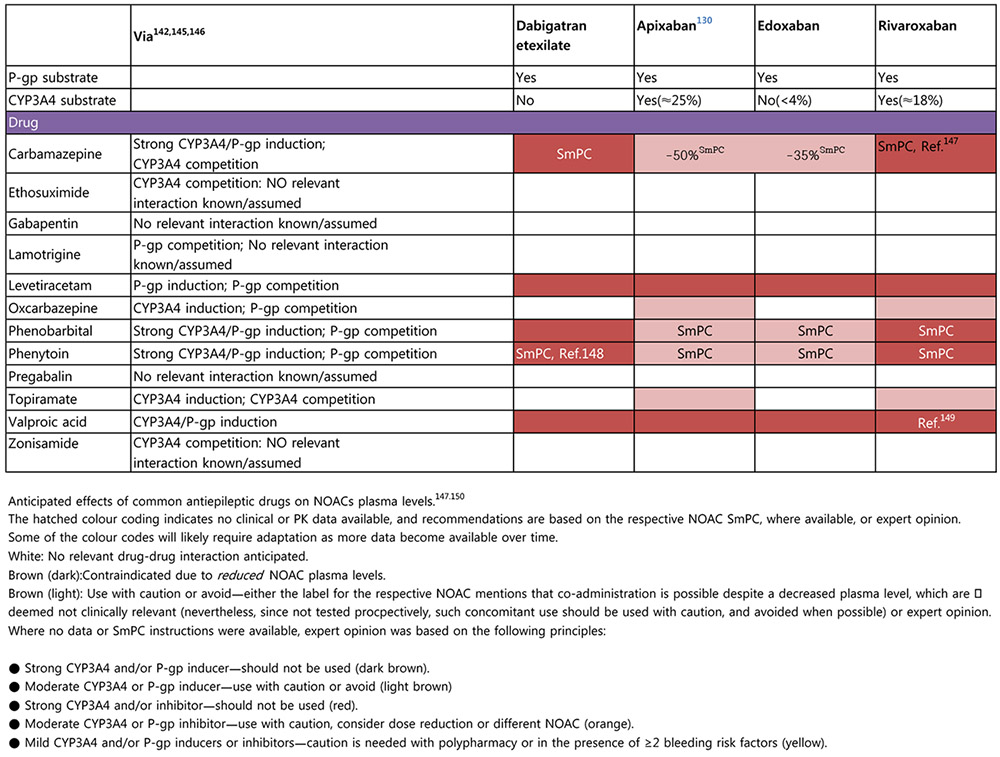
약물복용과 식사와의 관계에 있어, rivaroxaban은 식사 직후 복용을 하도록 해야 위장관에서 충분히 흡수가 되며, dabigatran 은 위장장애를 줄이기 위해 충분한 물과 함께 식사 직후 복용하도록 권고하는 것이 좋다. Apixaban 이나 edoxaban은 식사와 관계없이 아무때나 일정한 시간에 복용하도록 하면 된다. Nasogastric tube로 약물투여가 필요한 환자의 경우 dabigatran 을 제외한 apixaban, rivaroxaban, edoxaban 등을 사용할 수 있으나, 현재 우리나라 약물설명서에서는 공식적으로 apixaban과 rivaroxaban 을 pulvo 형태로 사용이 가능하다고 기술되어 있고, edoxaban의 경우에도 곧 개정할 가능성이 높다.

























